ワクチンの皮内投与の為の
デバイス(開発中)
Device for intradermal administration of vaccines
Lightnixは、「蚊」の針に着想を得た独自のワクチン投与デバイスにより、ワクチンを取り巻く社会課題を解消し、世界の感染症予防に対する国際的な医療革新を目指しています。
ライトニックスが開発を進める
ワクチンの皮内投与の為のデバイス
皮内という免疫細胞が豊富に存在する部位に安定・簡便にワクチンを投与するデバイスを目指します

ライトニックスの皮内投与デバイスイメージ

【コンセプト】
- ワクチン投与量を筋肉内投与(IM)に比べ削減しても同等の活性を維持できる皮内投与(ID)デバイス
- 手技の難しい皮内投与をスタンプの様に皮膚にデバイスを押し当てるだけで簡便、安定的に投与可能にすることを目指し、開発を進めています。
- 針は、世界初の樹脂製ランセット針“ピンニックス ライト”の技術を応用しています。針は生分解性樹脂でできており環境にも配慮しています。
ワクチン皮内投与に関する学術情報はこちらから確認できます。

【監修】
聖マリアンナ医科大学 リウマチ・膠原病・アレルギー内科 教授
東京医科歯科大学 大学院医歯学総合研究科 寄附講座 生涯免疫難病学講座 寄附講座教授
森 雅亮
SOCIAL ISSUESワクチンに関する社会課題
世界の感染症予防については現在、多くの社会問題が残されています。
ワクチンは人類の歴史上、最も人命を救済してきた医薬品であると言っても過言ではありません。
一方で、その需要の高さから全世界的な供給が未だ十分でなく、様々な課題が指摘されています。
途上国の現状
ワクチンの供給量や経済的事情により、途上国では十分なワクチン供給が受けられず、先進国と途上国では感染症予防に格差が生じています。
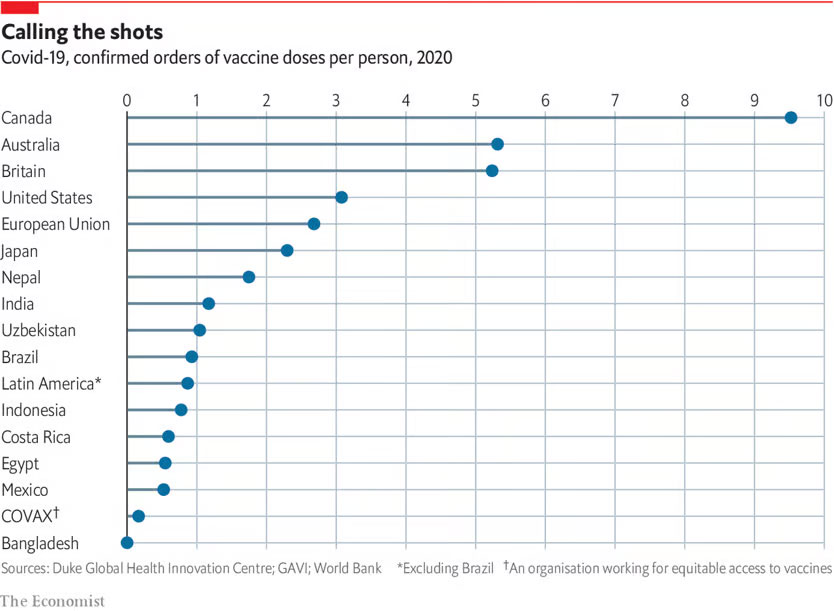
出典:The Economist, Rich countries grab half of projected covid-19 vaccine supply, 2020.
途上国で亡くなる0~4歳の死因のうち、先進国で治療が可能な疾患は40%を占めます。ワクチンが高価なために途上国では入手できるワクチンが限定的であることに起因します。
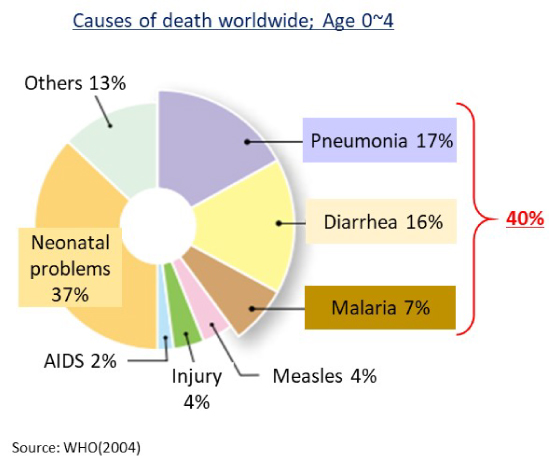
出典:世界の5歳未満の死亡要因, WHO, 2004. より改変
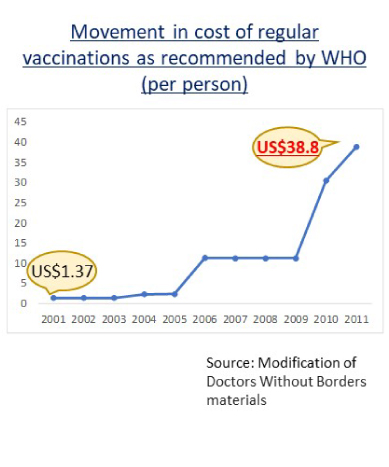
出典:WHO推奨の定期予防接種費の推移, 国境なき医師団
また、途上国ではワクチンの購入コストを抑える必要があるため、多くの種類のワクチンで1バイアルに多人数分のワクチンが充填されたMulti-dose Vialの形態で供給されています。
しかしながら、Multi-dose Vialでは充填された人数分が使い切らずに廃棄されてしまう量が課題となっています。

出典:DCVMN, カンボジアおよびナイジェリアにおけるコロナワクチン廃棄率
このため、1回の使用ごとに個別包装された単回使用のSingle Dose Vialで、かつ現状よりも安価なワクチンの供給が求められています。
医療従事者不足
パンデミックのように、一斉に大量の人数にワクチン投与する必要が生じた場合、ワクチン投与のための医療従事者不足が課題となります。ワクチン調製といった事前準備の負担もあり、簡便かつ事前準備負担の少ない投与デバイスが求められています。
更にワクチン注射方法には筋肉注射、皮下注射、皮内注射のように複数の注射方法がありますが、後述する皮内注射のように高い注射技術が求められる方法では、更に施術可能な医療従事者が限られてしまうことも、世界のワクチン普及についてボトルネックを形成する一因ともなっています。
環境問題
途上国では使用後の注射器廃棄も大きな課題です。
不法投棄、焼却処分出来ない医療針による環境汚染、針刺し事故による二次感染リスク
2022年2月のWHOによる全世界対象調査の結果、731,000 Lの薬液廃棄物(ワクチン薬剤含む)、144,000 tの固形廃棄物(シリンジや針を含む)、廃棄物回収時に10-20%の頻度で針刺し事故が発生していることが明らかとなりました。
Tonnes of COVID-19 health care waste expose urgent need to improve waste management systems, WHO; 2022.
https://www.who.int/news/item/01-02-2022-tonnes-of-covid-19-health-care-waste-expose-urgent-need-to-improve-waste-management-systems
従来のシリンジでは使用済み針による二次感染リスクや、現在では針の無いNeedle Free Deviceも開発は進んでいますが、途上国で普及可能な低コスト、使用後に焼却可能な材質など、途上国のワクチン普及を抜本的に解決可能なワクチン投与デバイスの開発には未だ多くの課題が残されている現状です。
SCIENCE皮内投与ワクチンの利点と臨床的背景
ワクチンの供給不足や購入コスト等については、これまでも世界的に議論が進められ、使用料を抑えつつも同等の効果が得られる投与方法として、皮内へのワクチン投与の研究や一部の臨床への応用が進んできています。
ワクチンの皮内投与とは
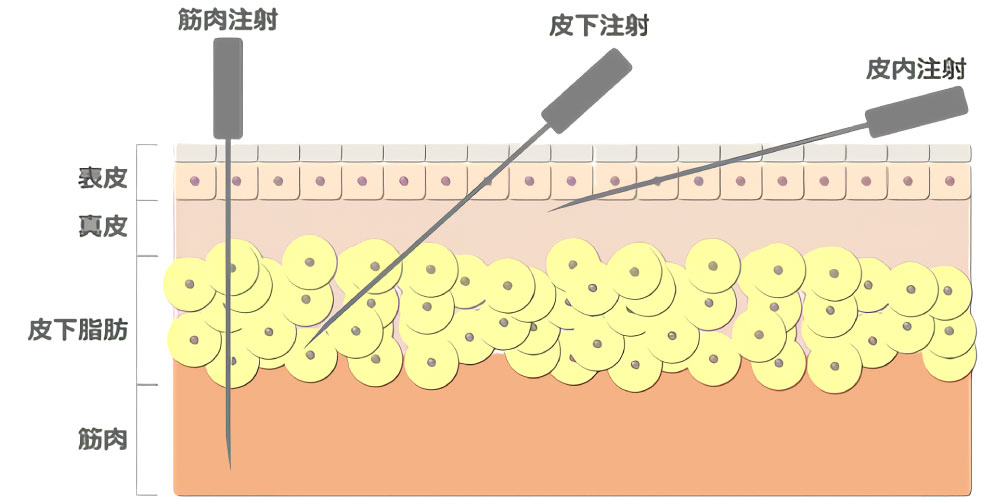
ワクチンの注射方法は大きく筋肉注射(筋肉内投与)、皮下注射(皮下投与)、皮内注射(皮内投与)に分けられますが、皮内投与では他の注射方法と比較して大きなメリットを持つことが多くの研究により実証されています。
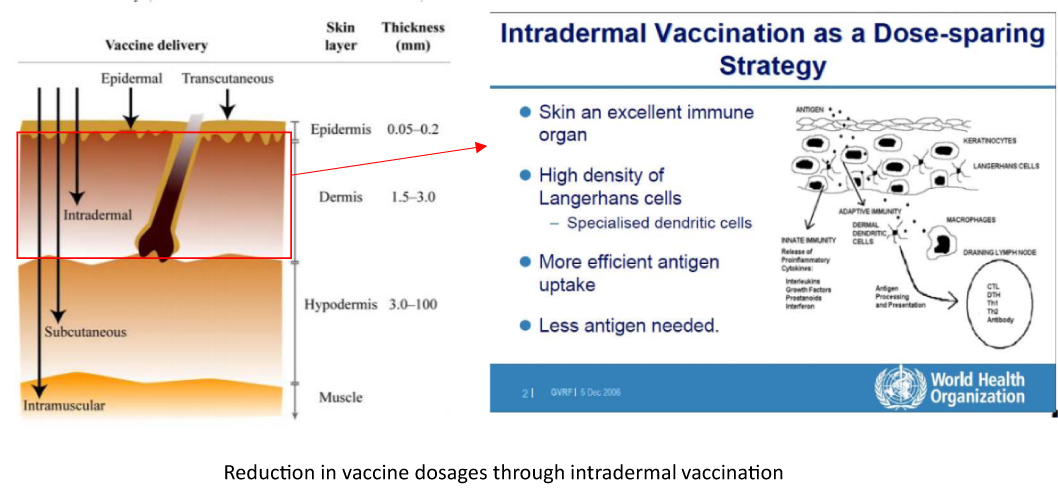
「皮内」とは表皮と真皮のごく浅い層のことを表し、免疫獲得に寄与する免疫細胞が高密度に局在することが知られています。
そのため、従来の主な投与ルートである筋肉内投与や皮下投与と比較して、皮内投与は高い免疫惹起能を持つことがWHOより報告されています。
筋肉内投与に対し、皮内投与はワクチン投与量を1/5に削減しても十分な免疫が獲得されることを報告されています。
皮内投与を用いることでワクチン量の削減が期待される
出典:Intradermal Delivery of Vaccines Report, WHO; 2009. および Global Vaccine & Immunization Research Forum, WHO; 2006. より改変
狂犬病のワクチン投与において皮内投与の使用をタイ赤十字が国際的に推奨しており、実際に80%のワクチン量
削減に成功しました(Vaccine. 2006 Apr 12;24(16):3084-6.)。
このレジメンはTRC-IDとしてWHOにより多くの国に推奨されてきた歴史的背景があります。
インフルエンザワクチンやその他、多くのワクチンにおいても皮内投与によるワクチン投与量の削減効果が報告
されており、臨床的な有用性が着目されています (N Engl J Med. 2004 Nov 25;351(22):2295-301.)。
IM=筋肉内投与、ID=皮内投与
| Immunogenicity of influenza vaccines 42 days after administration |
IM 15 μg (N=50) |
ID 3 μg (N=50) |
|
|---|---|---|---|
| Fold increase in GMT (Fold) |
H1N1株 | 12.7 | 13.4 |
| N3N2株 | 6.0 | 16.4 | |
| B株 | 13.1 | 10.4 | |
| Seroconversion rate (%) |
H1N1株 | 74 | 84 |
| N3N2株 | 60 | 78 | |
| B株 | 78 | 72 | |
| Seroprotection rate (%) |
H1N1株 | 90 | 86 |
| N3N2株 | 94 | 96 | |
| B株 | 100 | 92 | |
New England Journal of Medicine, Kenney RT, Frech SA, Muenz LR, Villar CP, Glenn GM, Dose sparing with intradermal injection of influenza vaccine, 351(22), 2295-301. Copyright © 2004 Massachusetts Medical Society.より改変
皮内投与による免疫惹起のメカニズム
皮内投与が高い免疫惹起能を持つ理由として、体内外を隔てて異物や感染源からのバリアを司る、皮膚機能に特有の免疫学的なメカニズムが研究により明らかになりつつあります。
《トピックス》皮内投与による免疫惹起のメカニズム

【監修】
東京医科歯科大学 大学院医歯学総合研究科
皮膚科学分野 教授
沖山 奈緒子
皮膚の構造と免疫細胞の局在
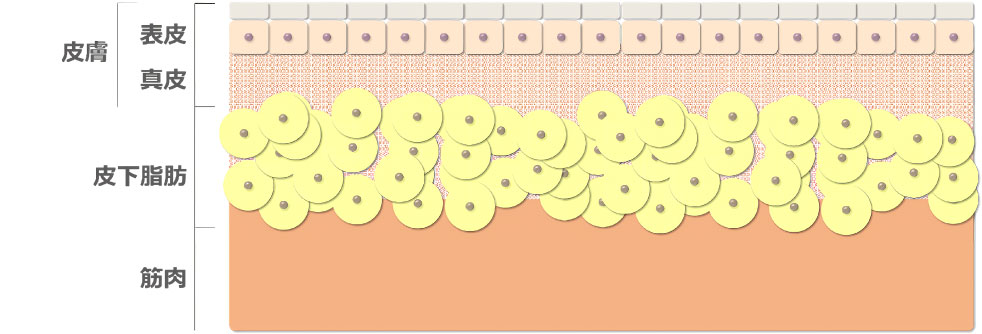
肌の構造は表皮、真皮、皮下脂肪、筋肉からなりますが、この内、皮膚は解剖学的には表皮と真皮のことを意味します。
ワクチンを注射する際には筋肉注射、皮下注射、皮内注射に大きく分けられます。
この内、当社が皮内注射の普及を目指している理由は皮膚に含まれる免疫細胞の密度が関係しています。
皮膚の構造は最表面から順に角層、顆粒層、有棘層、基底層の4層構造からなる0.2 mm程度の表皮、および基底層に接する乳頭層、その下に広がる網状層からなる1-2 mm程度の真皮によって構成されます。
体表から僅か2 mmのこの範囲には多くの抗原提示細胞が局在しているため、皮内注射では筋肉注射や皮下注射と比較して僅かなワクチン投与量でも高効率に免疫獲得能が惹起されます。
特に表皮は体表における異物侵入への免疫的防御に重要な役割を担うため、僅か約0.2 mmの表皮内には抗原提示能を持つランゲルハンス細胞が高密度に局在しています。
また表皮の下にある真皮にも抗原提示能を持つ多くの樹状細胞やマクロファージが局在しています。
真皮は殆どが膠原線維 (コラーゲン)、弾力線維 (エラスチン)、細網線維 (レチクリン)からなる線維性タンパク質のネットワークからなり、その中を線維産生細胞である線維芽細胞や、リンパ球、樹状細胞、マクロファージ、肥満細胞、形質細胞、好酸球、好塩基球などの免疫細胞が局在します。
樹状細胞、マクロファージは皮下組織や筋肉にも分布しますが、真皮内に特に高密度に局在しており、皮膚免疫における異物の貪食・分解、および抗原提示細胞としての役割を担います。
これら皮膚に局在する抗原提示細胞は体表から表皮や真皮へ侵入した細菌やウイルス、アレルギー物質などの異物を取り込み、一部の異物に特異的な分子を細胞膜表面へ露出することでT細胞等の他の免疫細胞を活性化し、異物排除のための免疫が獲得されていきます。
表皮のランゲルハンス細胞および真皮の樹状細胞や
マクロファージによる免疫獲得
表皮に局在するランゲルハンス細胞や真皮の樹状細胞と、真皮以下に局在するマクロファージでは免疫獲得に働く機序が異なります。
まず真皮以下に局在するマクロファージについては異物の貪食・分解を行う細胞性免疫が主な役割であり、異物の侵入やウイルス感染により活性化された後は好中球やナチュラルキラー細胞 (NK細胞) など他の貪食細胞を動員するサイトカインを分泌して免疫細胞の集簇を促進、つまり炎症を生じさせながら患部局所に留まり、異物の貪食を行います。
また貪食した一部の分子を抗原として細胞膜表面に提示することで、抗体産生の司令塔となるヘルパーT細胞 (Th細胞) へ認識させ、抗体産生を行うB細胞の活性化による抗体産生の促進、抗体による異物排除という体液性免疫の起点にもなります。
一方で、表皮に局在するランゲルハンス細胞や真皮樹状細胞は異物の貪食後はマクロファージと異なり近隣の所属リンパ節へ移行します。
異物を取り込んだ樹状細胞は真皮以下に走行するリンパ管へ遊走し、リンパ管を取ってリンパ節へ移行します。リンパ節内には多数の免疫細胞が集簇しており、リンパ節内に移行した樹状細胞は細胞膜表面に提示した抗原を、免疫活性化の司令塔であるTh細胞を活性化し、B細胞による抗体産生や、強力な細胞傷害細胞であるNK細胞や細胞傷害性T細胞 (CTL) の感染細胞の殺傷を誘導します。
また、マクロファージとの大きな違いとして、マクロファージは未熟なT細胞を活性化する力はありませんが、ランゲルハンス細胞や樹状細胞は抗原を一度も受容したことのない未熟なナイーブT細胞から免疫機能を備えて成熟したエフェクターT細胞への分化を誘導することが出来ます。
マクロファージとランゲルハンス細胞・樹状細胞の免疫獲得は誘導する免疫に違いがあります。
マクロファージはあくまで細胞性免疫が主な役割であり、抗体産生の惹起能は樹状細胞には劣ります。
一方でランゲルハンス細胞や樹状細胞ではナイーブT細胞から各種のエフェクターT細胞へ分化させる誘導能力があるため、細胞性免疫と体液性免疫の両方の強力な起点となり、マクロファージと比較して強力な抗体産生を誘導することが出来ます。ランゲルハンス細胞は皮膚外の蛋白レベルの抗原を取り込むことが出来る一方、真皮樹状細胞は真皮内に入ってきた抗原を取り込んで抗原提示します。
このため、主にマクロファージによる免疫獲得となる筋肉注射や皮下注射と比較して、よりマクロファージが高密度に局在し、また樹状細胞による強力な免疫獲得能を持つ皮内投与はワクチンによる免疫獲得を高効率に行えることが示唆されています。
皮内投与の難しさ
以上のように免疫獲得の効率向上が期待される皮内投与ですが、施術手技の難しさによって普及に歯止めが掛かっている状況です。
皮内投与は表皮から1-2 mmまでのごく浅い部分を狙って注射する方法です。
このため、皮膚に対して10°程度となるよう、ほぼ皮膚と水平に針を傾けて注射を行う高度な技術が求められます。
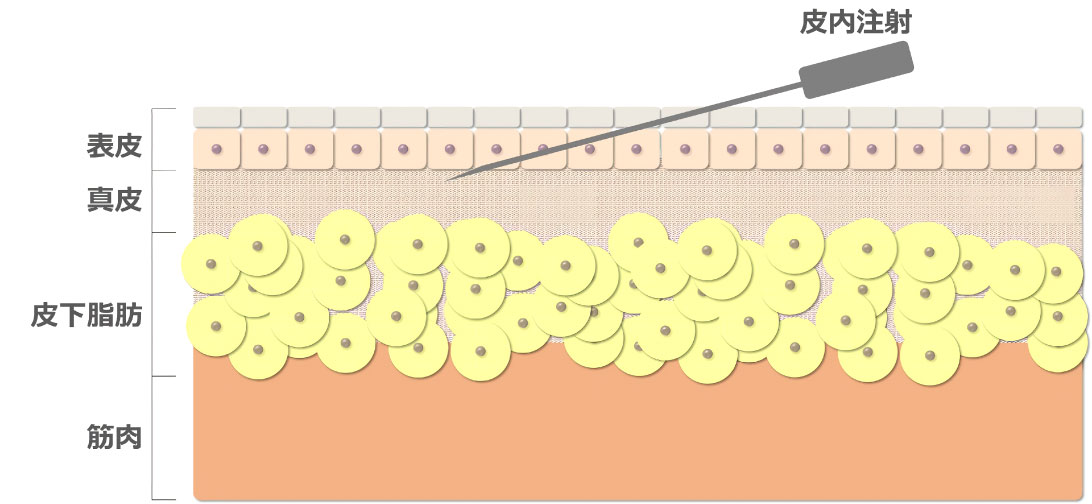
筋肉注射や皮下注射などの他の方法と比較して高い免疫獲得能が研究されている皮内注射ではありますが、高度な技術が求められることから実施可能な医療従事者が限られる点が普及のボトルネックとなっています。
このため、簡便かつ再現性が高く皮内注射を行うための投与デバイスが求められています。
PRODUCTSワクチンの皮内投与デバイスの紹介
弊社では皮内投与が持つワクチン投与量の削減効果やその他、様々な利点に着目して、皮内投与の普及に貢献するために簡便かつ確実な投与デバイスの実現を目指して開発を行っています。

当社デバイスのコンセプト
弊社ではワクチンの皮内投与デバイスの開発によりワクチンによる免疫獲得の向上と普及を目指しています。

弊社 ワクチン皮内投与デバイス(試作品)
- ワクチン投与量を筋肉内投与(IM)に比べ削減しても同等の活性を維持できる皮内投与(ID)デバイスの実現
- 手技の難しい皮内投与をスタンプの様に皮膚にデバイスを押し当てるだけで簡便、安定的に投与可能にすること
- 世界初の弊社 樹脂製ランセット針“ピンニックス ライト”の技術を応用し、生分解性樹脂製針の使用によりSDGsを満たしたデバイスであること
弊社デバイスでは、スタンプの様に押し当てることで針先角度の微妙な調節手技が必要無く、簡便かつ再現性高く実施可能な投与デバイスの開発を目指しています。
また、従来の金属針では廃棄後の針刺し事故による二次感染リスクが深刻な問題となっていましたが、弊社が開発したランセット針 PINNIXの技術を応用した樹脂製針を採用することで、使用後すぐに焼却可能となり、医療廃棄物に起因する二次感染リスクの解消もまた目指しています。
そして針を含む筐体の殆どが樹脂で構成されていることから安価であり、かつ滅菌済み個包装の形態で配布可能な供給体制を目指しています。
これにより、将来的には医療機関から各家庭へワクチン充填済みデバイスを配布し、各家庭において自己投与を可能とすることで、途上国におけるワクチン普及を劇的に推進できる未来を目指しています。
弊社デバイスの実証結果
弊社ではワクチンの皮内投与デバイスの開発によりワクチンによる免疫獲得の向上と普及を目指しています。
2019年から国のプロジェクトにも採択されデバイス開発を開始。
現在は前臨床から臨床への移行段階であり、製薬企業との協業を模索中
ラットを用いた実験結果では、モデル抗原として一般的に用いられる卵白アルブミン (OVA) を試作品デバイスによりラット生体へ投与した結果、筋肉注射の1/5のワクチン量にも関わらず筋肉注射と同等の血清中抗体力価 (IgG Titer) が得られました。
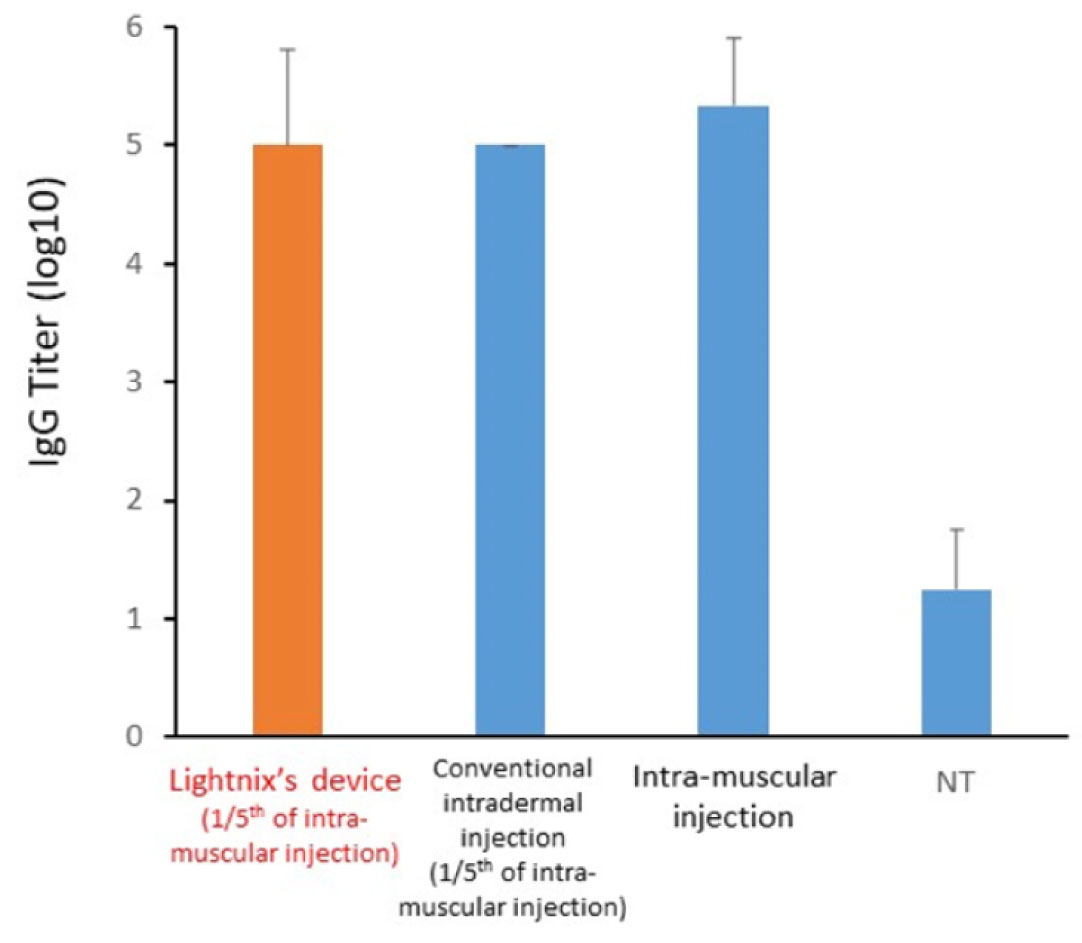
弊社 ワクチン皮内投与デバイス(試作品)によるラットへのOVA投与実験の結果。
筋肉注射の1/5ワクチン量を弊社デバイスにより皮内投与した結果、筋肉注射と同等の抗体力価への上昇が認められた
また、インフルエンザウイルスに人獣共通感染を生じることから、インフルエンザ感染症のモデル動物として常用されるフェレット生体を用い、実際にインフルエンザワクチンを投与した実験においても、弊社デバイスによるワクチンの投与量削減効果が認められました。
筋肉注射(筋肉内投与)と比較して1/5量のワクチン投与でも十分な免疫獲得が認められ、ワクチン投与量の削減効果を実証する結果が得られました。
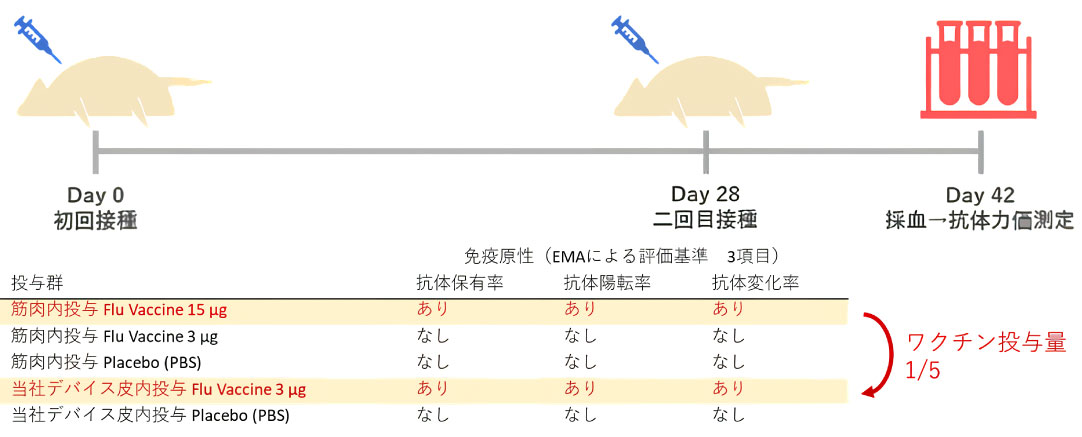
生体フェレットへのインフルエンザワクチン投与2週間後の免疫原性評価
欧州医薬品審査庁 (EMA) 基準による3項目全てで筋肉内投与の1/5量で免疫獲得能(表記載:免疫原性)を実証済み。
EMAではインフルエンザワクチンの評価基準について3項目いずれかの免疫原性が認められることを条件としている中、弊社デバイスでは3項目全ての基準について免疫原性が認められました。
以上の実験結果はAMED(国立研究開発法人
日本医療研究開発機構)のプロジェクト採択による支援下で実施され、弊社デバイスを用いた皮内投与によるワクチン投与量削減効果の実証に至りました。
その他、様々な薬理的利点
ワクチン投与量の削減のほかにも、皮内投与では様々な薬理的利点が示唆されています。
筋肉よりも皮内では血管走行量が少ないため、ワクチンが血流に乗って全身循環しにくく投与されたワクチンが投与部位に限局され、副反応が全身性ではなく投与部位局所に限局しやすい点
筋肉注射ではワクチンが効かなかった体質の方※でも皮内注射に切り替えることで免疫獲得が唆される点
(※ ノンレスポンダー群。
例えば、HIV罹患患者は一般的なB型肝炎ワクチンの接種では免疫獲得が惹起されにくい一方、皮内注射ではワクチンによる免疫獲得が向上した等の事例が示唆されています。
Yoshimura Y, Sasaki H, Miyata N, Tachikawa N. Intradermal Hepatitis B Vaccination in Non-responder People Living with Human Immunodeficiency Virus in Japan. Jpn J Infect Dis. 2022 Sep 22;75(5):519-522. doi: 10.7883/yoken.JJID.2021.834. Epub 2022 Apr 28. PMID: 35491226.
Filippelli M, Lionetti E, Gennaro A, Lanzafame A, Arrigo T, Salpietro C, La Rosa M, Leonardi S. Hepatitis B vaccine by intradermal route in non responder patients: an update. World J Gastroenterol. 2014 Aug 14;20(30):10383-94. doi: 10.3748/wjg.v20.i30.10383. PMID: 25132754; PMCID: PMC4130845.)
以上の薬理的利点をはじめとして、ワクチンの皮内投与に関する研究は今後も多くの報告が期待される方法です。
PURPOSELightnixが目指す未来
ワクチンの供給不足や購入コスト等については、これまでも世界的に議論が進められ、使用料を抑えつつも同等の効果が得られる投与方法として、皮内へのワクチン投与の研究や一部の臨床への応用が進んできています。
感染症予防に対する医療革新
簡便かつ安価な皮内投与デバイスを提供します。
これにより、ワクチン投与量の削減や有害事象の低減などの皮内投与の薬理的利点を提供し、幅広い感染症予防において以下の実現に向けた開発と医療革新を目指して参ります。
突発的に発生してワクチンが不足するパンデミック時に、より多くの方にワクチン供給を可能にする
ワクチンの購入コスト削減により、途上国を含む世界的なワクチン接種率を向上する
全身性および重篤な副反応リスクを低減し、より安全なワクチン接種を可能にする
筋肉注射では免疫獲得が得られにくいワクチンに対して、より高効率な免疫獲得を可能にする
各家庭へワクチン充填済みデバイスを配布し、自己投与を可能とすることで、途上国におけるワクチン普及を劇的に推進する













